보험공단 11월 7일 약가협상 재개...반응율 59%인데 생존기간은 입증 없어
약가협상은 지난 13일 결렬된데 이어, 20일에도 결렬된 것이다.
결국 타그리소의 비싼 몸값에 한정된 보험예산을 가진 보험공단이 동의를 하지 않았거나 보험공단의 제시가에 아스트라제네카가 협의를 결렬시켰다는 것이다.
약가협상은 결국 11월 7일 재논의하기로 했다. 검증도 안된 항암제를 건강보험에 급여가를 지원할 수 있을까?
약가협상은 감정적 부분이 아닌 이성적 부분으로 해야한다. 아무약이나 상관없이 무조건 급여적용을 시키면 당장은 좋겠지만, 그렇게 되면 나중에는 삼성전자나 현대자동차의 수출로도 감당할 수 없을 수준의 막대한 무역적자를 국가가 부담하게된다.
약가적자가 국가적으로 감당할 수 없는 무역적자의 수준이 되면 국가는 부도나고 그러면 중증환자의 보험은 당연히 축소된다.
국민건강보험을 통해 약가를 지원할 수 있지만, 모든 약을 지원하는 것은 불가능하다. 그러면 정말로 필요하고 대체가 불가능한 의약품들을 우선적으로 급여적용하고 지원해야 이치에 맞다.
아스트라제네카의 타그리소가 정말로 엄청나고 대체불가능한 항암제인가? 이부분은 개인이 판단할 수 있는 영역이 아니다. 따라서 타그리소의 객관적 입증된 임상결과를 객관적으로 나열한다.
먼저 반응율에 대해 언급하자면 항암제를 투여하고 종양에 효과가 있다고 판단할 만한 반응을 보이는 비율을 말한다. 중간 생존기간은 평균이 아닌 치료대상 절반이 사망한 기간을 의미한다. 중간반응기간은 해당 항암제로 암환자 절반이상이 항암치료에 실패하는데 걸린 시간을 말한다. 타그리소는 단독 사용의 중간반응기간에 대한 일반 공개데이터가 없다.
미FDA데이터에 따르면, 타그리소는 여러 지역의 임상센터에서 대조군 없이 오픈라벨(의약품명을 공개)형식으로 진행됐다.(multicenter, single-arm, open-labe)
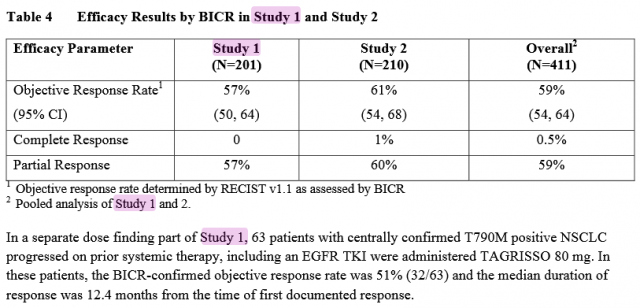
타그리소의 반응기간(종양이 자라지 않는 기간)은 직전 항암제의 반응이 보고된 시점을 기준으로 중간값이 12개월이었다. 63명을 대상으로 32명만이 타그리소에 반응했는데, 그기간이 이전 항암제 사용기간까지 합해서 중간값이 12개월이다. 중간값인 12개월에는 타그리소에 반응하지 않은 31명은 포함되지 않았다.
타그리소 단독의 항암제 반응기간이 아니라 이전치료제 반응이 처음 보고된 시점(the time of first documented response)에서 12개월이 중간값이라는 것이다.
63명을 대상으로 이전 항암요법의 반응율과 반응을 보인 시점에서 첫번째 항암요법이 실패하고 두번째로 타그리소를 투여했는데 32명중 절반이 12개월만에 첫번째 항암제와 두번째 항암제인 타그리소역시 실패했다는 뜻이다. 31명은 타그리소를 투여하였으나 반응이 없어 실패했다는 의미다.
요약하면 타그리소 처음 시도에서 반응이 없어 실패한환자가 절반인 31명이고, 1차항암에 실패하고 2차항암제인 타그리소역시 실패한 암환자가 12개월만에 32명 중 절반이라는 것이다.
임상결과는 반응기간 중간값이고 평균값은 언급되지 않았다.(통상적으로 평균값이 훨씬 불리하다)
한편 반응을 보이지 않은 대상을 중간값에 포함시킨다면 타그리소의 기여분에 대해선 중간값이 0개월이 된다. 63명중 31명이 반응하지 않았기 때문에 반응을 보인 대상중 반응기간이 가장 짧은 첫번째가 중간값이 되기 때문이다.
객관적으로 말하자면 항암제에 있어서 반응율이라고 하는 것은 임상에서 항암제 임상의 성공을 점쳐볼 하나의 지표에 불과하다. 실제적 지표는 반응율이 아니라 생존기간 연장의 효과를 입증해야 한다.
대조군 없이 싱글암으로 진행된 타그리소 임상으로는 가장 중요한 지표인 생존기간 연장을 입증할 수가 없다(single-arm, open-labe).
[In a separate dose finding part of Study 1, 63 patients with centrally confirmed T790M positive NSCLC progressed on prior systemic therapy, including an EGFR TKI were administered TAGRISSO 80 mg. In these patients, the BICR-confirmed objective response rate was 51% (32/63) and the median duration of response was 12.4 months from the time of first documented response.]
타그리소를 객관적이고 냉철한 눈으로 봤을 때 공개된 지표는 반응율이 전부다. 이 반응율이 얼마나 유지되는지도 확인되지 않을 뿐만아니라 생존기간 연장에 얼마나 기여할 수 있는지도 판단할 수 없다.
반응율이라는 것은 참고할 순 있어도 그자체를 효과로 인정하기 어렵다. 어차피 종양은 줄여도 다시 자란다.
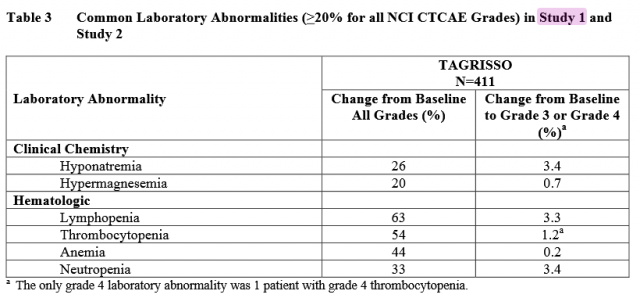
타그리소의 혈액독성은 33~63% 사이로 부작용이 특별히 낮지는 않았다. 주요 혈액독성 이상반응은 림프구감소증 (lymphopenia), 혈소판 감소증 (thrombocytopenia), 빈혈 (anemia), 백혈구 감소증 (leukopenia) 순으로 빈번하게 나타났다.
타그리소가 정말로 국민보험의 막대한 리스크를 짊어질만큼 엄청난 신약 항암제일까? 이 것은 전문가인 건강보험공단이 판단할 일이다.
그동안 폐암에 신약이라는 신약은 무수히 나왔는데 결과적으로 폐암환자의 수명은 얼마나 개선됐을까?
정확한 데이터를 바탕으로 하지 않은 지나친 기대는 결국 배반당하기 마련이다.
---------------<아래 본기사에 대한 유관 단체의 반박 원문 추가>------
본 기자의 입장.
본 기사에 대해 유관단체에서 항의 및 내용 정정을 요청하여 해당 단체의 입장을 수정없이 전문을 본 기사의 후반에 반영합니다.
해당 단체에서 인용한 임상결과는 본 기자가 확인한 결과 AURA3 (NCT012151981) 임상으로 보여지며, 유관단체의 올리타 관련 주장은 본 기자의 의견과 무관합니다.
그리고 해당단체에서 사용한 표에 무진행 생존기간을 생존기간연장(무진행 생존기간)으로 표시하였으나 무진행 생존기간은 생존기간 연장과 전혀 다른 의미이고, 생존기간연장은 항암제의 효과를 명확하게 알수 있는 지표이지만 무진행생존기간은 항암제의 효과를 간접적으로 알 수 있을 뿐이고 무진행 생존기간을 생존기간 연장으로 표현할 수 없습니다.
따라서 명백하게 문제가 있는 내용에 대해 빨간줄로 표시하였습니다.
또한 해당 단체가 인용한 임상 AURA3에 대한 간단한 요약을 먼저 하도록 하겠습니다.
AURA3 임상은 타그리소를 1차 항암제로 사용한 임상으로, 비교대상은 경쟁약품인 이레사, 타세바 대비 효과를 입증한 임상이 아닌 표준 항암제인 시스플레틴과 임상대조한 결과입니다.
임상결과 타그리소는 반응기간(response durations)이 11개월이었고, 백금계열항암제는 반응기간이 4.2개월 이었습니다.
한편 타그리소는 뇌전이 종양(baseline brain scans)의 측정가능한 반응 기간이 측정되지 않았으며 1.4개월에서 12.5개월의 범위를 보였습니다.(range: 1.4 to 12.5 months) 반면 항암제는 뇌전이에 대해 중간 CNS 반응기간이 5.7 개월이고 범위는 1.4개월에서 5.7개월이었습니다.(range: 1.4, 5.7 months)
결론은 타그리소는 백금항암제 대비 1차항암제로 사용한 결과 우수성(무진행생존기간 7개월)을 입증했습니다. 그런데 AURA3 임상은 1차항암제로 타세바, 이레사 대비 우수성을 입증한 임상은 아닙니다.
뇌전이 환자에 대해서도 부정확한 데이터임에도 불구하고 백금항암제 대비 우수성을 입증했으나 역시, 타세바, 이레사 대비 우수성을 입증한 임상은 아닌 것으로 보여집니다.
또한 2차, 3차 항암로 사용할 경우 대체 불가능할 정도의 생존기간연장 효과가 있는지 입증한 것도 아닌 것으로 보여지며, 무진행생존기간의 효과역시 입증된것으로 볼 수 없습니다.
2차, 3차 항암제와 대조는 싱글암으로 임상이 진행됐기 때문에 무진행 생존기간의 연장이 있었는지 확인이 불가하고 타그리소 단독의 무진행생존기간이 얼마인지도 공개되지않아 확인할 수 없는 상태입니다.
또한 아래의 "타그리소를 먹고 언어장애가 없어진 환자, 다시 걸을 수 있는 환자가 수두룩하다"라는 표현에 대해서는 본 기자가 확인한 바 없으므로 구체적인 사실여부를 확인해 드릴 수 없으나, 해당 단체의 주장을 그대로 실어드림을 밝힙니다. 그러므로 수두룩하다는 표현의 책임은 유관단체에 있음을 밝힙니다.
아래 AURA3 임상 원문<출처 : 미 FDA>
[On March 30, 2017, the U.S. Food and Drug Administration granted regular approval to osimertinib (TAGRISSO, AstraZeneca Pharmaceuticals, LP) for the treatment of patients with metastatic epidermal growth factor receptor (EGFR) T790M mutation-positive non-small cell lung cancer (NSCLC), as detected by an FDA-approved test, whose disease has progressed on or after EGFR tyrosine kinase inhibitor (TKI) therapy.
In November 2015, osimertinib received accelerated approval for this indication based on an overall response rate (ORR) of 59% among 411 patients in two single-arm clinical trials.
The current approval is based on AURA3 (NCT012151981), a randomized, multicenter open-label, active-controlled trial conducted in patients with metastatic EGFR T790M mutation-positive NSCLC who had progressive disease following first-line EGFR TKI therapy. All patients were required to have EGFR T790M mutation-positive NSCLC identified by the cobas EGFR mutation test performed in a central laboratory.
AURA3 randomized 419 patients (2:1) to receive osimertinib (n=279) 80 mg orally once daily or platinum-based doublet chemotherapy (n=140). Patients in the chemotherapy arm received either pemetrexed, 500 mg/m2 with carboplatin AUC5, or pemetrexed, 500mg/m2 with cisplatin 75 mg/m2), on day 1 of every 21-day cycle for up to 6 cycles followed by pemetrexed maintenance therapy. Patients on the chemotherapy arm with radiological progression according to both investigator and blinded independent central review were offered osimertinib at progression.
AURA3 demonstrated an improvement in investigator-assessed progression-free survival (PFS), with a hazard ratio of 0.30 (95% CI: 0.23, 0.41; p<0.001). The estimated median PFS was 10.1 months in the osimertinib arm and 4.4 months in the chemotherapy arm. Confirmed ORR, according to investigator assessment, was 65% (95% CI: 59%, 70%) and 29% (95% CI: 21%, 37%) in the osimertinib and chemotherapy arms, respectively (p<0.0001). Estimated median response durations were 11 months (95% CI: 8.6, 12.6) and 4.2 months (95% CI: 3.9, 5.9) in the osimertinib and chemotherapy arms, respectively.
In patients with measurable central nervous system (CNS) lesions on baseline brain scans, the confirmed CNS ORR, assessed by independent central review, was 57% (95% CI: 37%, 75%) and 25% (95% CI: 7%, 52%) in the osimertinib and chemotherapy arms, respectively. The median CNS response duration was not reached in the osimertinib arm (range: 1.4 to 12.5 months) and was 5.7 months (range: 1.4, 5.7 months) in the chemotherapy arm. Overall survival data are immature. ]
-------------------------<유관단체 반박글 원문 아래>--------------------
‘타그리소’가 꼭 필요한 환자가 있습니다!! ‘올리타’는 ‘타그리소’를 대체할 수 있는 약이 아닙니다!!
타그리소와 올리타는 말기 폐암 환자를 위한 표적항암제입니다. 하지만, 건보공단의 주장과 같이 두 약이 같은 약은 아닙니다.
타그리소는 이미 3상 임상시험 결과가 나왔고, 여기서 화학요법보다 2배 이상 생존기간을 연장시키는 것이 확인됐습니다. 하지만 올리타는 아직 임상시험이 진행 중인 약입니다. 하루가 절실한 폐암 말기 환자라면 어떤 약을 먹어야 합니까?
더군다나 타그리소는 40%에 달하는 뇌전이 폐암환자에서도 효과가 뛰어납니다. 주변에 타그리소를 먹고 언어장애가 없어진 환자, 다시 걸을 수 있는 환자가 수두룩 합니다. 타그리소가 없다면, 이 환자들은 어떤 약을 먹어야 합니까?
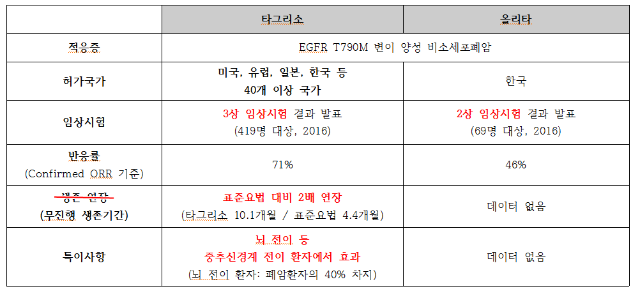
폐암의 뇌전이된 환자는 말기 환자입니다. 뇌전이 환자는 타그리소를 사용해야 합니다. 단순히 대체약품이 있다고 바꾸어 쓸 수가 없습니다. 생명에 영향을 주고 치료기간중에 삶의 질이 문제가 됩니다!!! 항암하시는 분들의 고통이 심해서 기급적 부작용이 적고 효과가 있는 것 약을 쓸 수 있어야 합니다. 올리타는 부작용이 심해서 타그리소로 갈라타는 현상이 일반입니다. 대체 약품이라는 단어는 사용하시면 안됩니다.

