
▲ 필러 ㅣ 출처=다음블로그
■필러의 역사 : 보툴리눔 톡신=의약품으로 필러 대비 진입 장벽 높아
필러는 미용적인 부피가 증강될 필요가 있는 부위에 주입되는 물질로 정의할 수 있다. 의약품으로 분류되는 보툴리눔 톡신과 달리 필러는 의료기기로 분류된다. 제품 개발에서 생산까지 의약품보다 기준이 낮기 때문에 진입 장벽은 높지 않다.
보툴리눔톡신은 1g으로 100만명을 사망시킬 수 있는 맹독물이다. 1975년에 발효된 국제적 생물 무기금지 협약(국내에는 1987년 발효)의 대상물질이다. 제조나 획득, 보유, 비축 및 이전해 사용할때 모두 신고하거나 수출입 허가 신고(한국 바이오 산업협회, 지식경제부)를 해야한다. 국제적인 규제로 후발 주자들이 시장에 진입하기 쉽지 않다. 제조 과정에서도 맹독성 단백질 원료인 이유로 제조시 Biosafety level 3 기준 건물 및 장비가 필요하다.

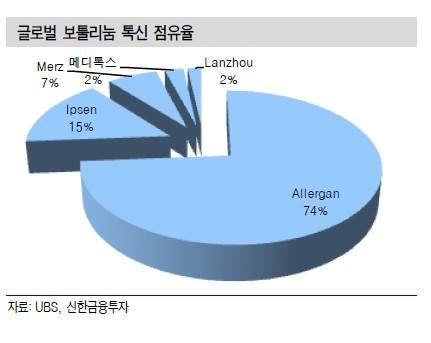
Solstice의 Myobloc을 제외하고 모두 항원이 A형이다. 대부분 A형의 보툴리눔 톡신이 판매된다. B형 제품은 A형 제품의 항체가 발생했을 때 주로 사용된다.글로벌 보툴리눔 톡신 점유율 1위는 Allergan으로 브랜드명은 널리 알려진 Botox다. Dysport를 보유한 Ipsen의 점유율은 15%로 2위다. Merz(Xeomin)와 메디톡스(Meditoxin)의 점유율은 각각 7%와 3%다.
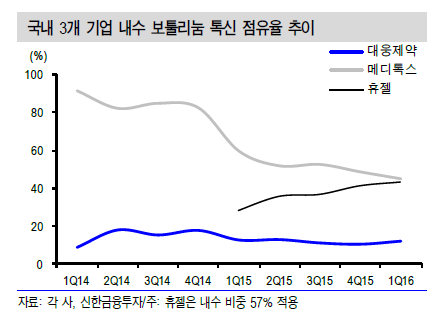
국내 시장에서 휴젤의 내수 점유율이 증가 추세다. 해외 기업의 경우 정확한 매출액이 공개되지않아 국내 보툴리눔 톡신 기업 매출액으로 점유율을 계산했다. 휴젤의 점유율은 2016년 1분기 기준 43.4%로 1위인 메디톡스(45.0%)에 근접하고 있다. 대웅제약의 점유율은 2014년 1분기 8.3%에서 2016년 1분기 11.7%로 상승했다.
1893년 독일 의사 Neuber가 환자의 팔에서 떼어낸 지방 조직을 얼굴 결손 부위에 이식한 작업을 최초의 필러 시술로 정의한다. 지방 이식도 연조직 시술이기 때문에 광의의 필러 시술로 볼 수 있다. 주사기를 이용한 지방주입은 1911년 Bruning 박사가 최초로 시도했다.
자가 지방이 아닌 외부 물질을 이용한 최초의 필러는 파라핀이다. 1899년 의사 Gersuny가 환자 음낭의 결손 부위를 메우기 위해 파라핀을 주입한 시술을 최초로 본다. 1902년 경 파라핀등의 오일에 의한 이물 육아종(이물질로 인해 생긴 염증), 주사 물질의 이동 부작용이 발견됐다.
이로 인해 1920년 이전에 미국과 유럽에서 파라핀 사용이 금지됐다.
인공 합성 물질 필러는 액상 주입 실리콘이다. 1940년대 초 남미, 아시아에서 유방 확대를 위해 처음 사용됐다. 미국에서는 1950~60년대 인기를 끌었다. 하지만 심각한 부작용이 발생됐고 의학적으로 안전성이 확보되지 않아 미국 FDA에서 1991년 액상 실리콘을 금지 약물로 규정한다.
현재 주사형 필러의 효시는 소 콜라겐 필러에서 시작됐다. Inamed사(현재 Allergan에 피인수)의 Zyderm I/II와 Zyplast가 1980년대 초 각각 미국 FDA에 승인을 받았다. 소 콜라겐 필러는 1980~2000년대 초까지 필러의 Gold Standard로 인식됐다. 하지만 수명이 3~6개월로 짧고 주사 전에 피부 테스트를 미리 해야 하는 불편함이 있다. 소 콜라겐 필러와 더불어 또 하나의 동물성 콜라겐인 돼지 콜라겐 성분 Fibrel은 1985년 FDA 승인을 받았다.
동물 유래 콜라겐 뿐만 아니라 사람 콜라겐의 필러 이용에 대한 연구도 진행됐다. 동물 유래 콜라겐은 1980년대에 출시됐는데 사람 콜라겐의 경우 1992년 매몰형 임플란트 형태의 Alloderm이 출시됐다.
2003년 간편한 선충전 주사기 형태의 CosmoDerm I/II가 FDA 허가를 받았다. 하지만 이 시기에는 히알루론산 필러가 유행해 사람 콜라겐은 큰 주목을 받지 못했다.
■현재 필러 시장 주류는 히알루론산
콜라겐 이후 트렌드는 인공 필러로 변한다. 독일 성형 외과 의사 Lemperle이 1992년 PMMA라는 아크릴 고분자와 소 콜라겐을 1:3으로 섞어 출시했다. 2006년 비율을 1:4로 조정한 Artefill이 미국 FDA 허가를 받았지만 널리 사용되지는 않았다.
히알루론산이 인공 필러의 대중화를 이끌었다. 유럽회사 Q-Med사의 Restylane이 히알루론산 성분 필러로 미국 FDA에서 2003년 최초 승인을 받는다. Restylane 개발자는 비동물성 히알루론산인 NASHA(non-animal stabilized hyaluronic acide)를 개발해 1995년 특허를 획득했다. 칼슘 필러인 Radiesse는 히알루론산보다 이른 2001년 FDA허가를 받았다. 인체 유사 물질을 이용한 필러로 가장 긴 수명을 보유했다.
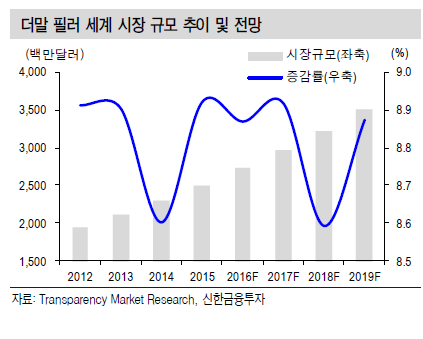
정리하면 필러의 트렌드는 인체에서 빼낸 자가 유래성 물질(human-derived material)인 자가지방에서 시작됐다. 이후 시술이 더 간단하고 효과가 오랫동안 지속되는 파라핀이나 액상 실리콘 같은 저급 비인체성 고분자(non-human polymer in low quality)가 사용됐다. 하지만 많은 부작용이 발생해 오랫동안 필러 시술이 활발히 이루어지지 않았다.
1981년 소 콜라겐 필러의 FDA 승인을 시작으로 인체 유사 물질(human tissue analogue) 개발이 활발해졌다. 인체 유사 물질은 우리 몸의 구성성분인 콜라겐이나 히알루론산이 예가 될 수있다. 저급 비인체성 고분자 대비 안전성이 개선됐지만 수명이 길지 않았다. 이를 보완하기 위해 PMMA나 PAAG 등 아크릴 고분자를 이용한 고급 비인체성 고분자(non-human polymer in high quality)들이 개발됐다.
상식적으로 생각하면 고급 비인체성 고분자 필러 확산이 타당하다. 수명이 더 길기 때문이다.
하지만 현재 PMMA나 PAAG보다 수명이 짧은 히알루론산 필러가 발전하고 있다. 필러의 수명이 길다면 필러의 부작용도 이에 비례하기 때문이다. 필러가 영구적이면 필러의 부작용도 영구적일 수 있다. 필러 시술 후 마음에 들지 않거나 부작용이 발생하는 경우 제거 작업이 진행되어야 한다. 현재로선 히알루론산 필러를 제외하고 다른 제품을 쉽게 녹이긴 쉽지 않다.
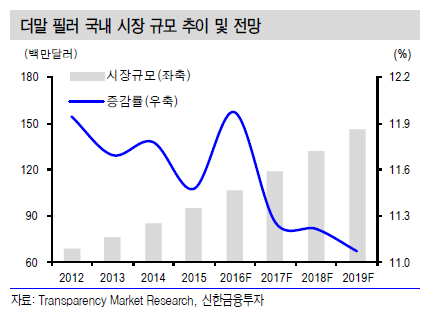
둘째는 가격이다. 필러 자체가 너무 고가이면 시술비도 이에 비례해 오른다. 환자 입장에서 지나친 고가의 필러는 보충 주사가 필요할 때 부담이 돼 충분한 양을 할 수 없다. 비정상적인 저렴한 제품을 사용할 경우 시술이 질이 낮고 부작용 발생 위험이 있다.
마지막으로 지속성이 중요하다. 안전하고 품질이 좋은 필러도 단시간 안에 꺼진다면 좋은 필러라고 할 수 없다.
[서울와이어 김지원 기자 jiwon@seoulwire.com]

