셀트리온, CT-P42 글로벌 임상 3상 결과… 안전성 발표해
삼천당제약, 아일리아 시밀러 바이알·PFS 국내 허가 신청
삼바에피스, SB15 임상 3상 완료… 품목 허가 신청 '아직'
글로벌 로슈, 바비스모 아일리아와 함께 해외 시장 확보
[서울와이어 양성모 기자] 국내 제약바이오 업계가 아일리아(성분명: 애플리버셉트) 바이오시밀러(바이오의약품 복제약) 출시에 공을 들이고 있다. 지난해 글로벌 12.6조원 매출을 올린 황반변성 치료제 아일리아의 특허, 독점권 만료가 다가오고 있어서다.
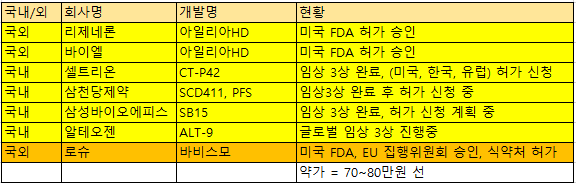
6일 제약바이오업계에 따르면 아일리아 시장은 오리지널 개발사인 리제네론 파마슈티컬스(리제네론)과 함께 셀트리온, 삼성바이오에피스, 엘테오젠, 삼천당제약 등 주요 제약사들이 바이오시밀러 경쟁을 예고하고 있다. 아일리아는 내년 5월 미국 내 신약 독점권 만료에 이어 유럽 물질특허도 내후년 11월에 만료될 예정이다.
셀트리온은 임상 3상 완료 후 미국과 한국, 유럽에 허가 신청을 냈으며, 삼성바이오에피스도 임상 3상을 마쳤다. 이를 통해 오리지널 대비 저렴한 가격에 바이오시밀러를 시장에 공급할 계획이다. 현재 아일리아 약가는 70만원 선이다.
최근 셀트리온은 아일리아 시밀러 CT-P42의 글로벌 임상 3상 결과를 통해 안전성을 발표했다. 또 면역원성에서도 오리지널 의약품과 유사한 결과를 나타냈다고 설명했다. 셀트리온은 지난 6월 부터 순차적으로 미국, 한국, 유럽에 CT-P42의 허가 신청을 완료한 바 있다.
삼천당제약은 아일리아 시밀러(SCD411)의 바이알 및 프리필스 시린지(PFS) 두 제품을 동시에 국내 허가 신청했다. 또한 최근 SCD411 유럽 5개국 독점판매권 및 공급 계약을 체결했다. 삼천당제약은 지난달 23일 공시를 통해 유럽 5개국 계약 건의 예상 매출 규모가 최소 1조5000억원을 넘어설 것으로 기대된다고 밝혔다.
삼성바이오에피스는 SB15(아일리아 바이오시밀러) 임상 3상이 완료됐으며 아직 해외 품목 허가 신청은 계획중이라 밝혔다. 임상 3상 최종 데이터에 따르면 미국과 한국 등 10개국에서 신생혈관성(습성) 연령 유관 황반변성 환자 449명을 대상으로 진행한 결과 오리지널 의약품 대비 동등성과 안전성, 면역원성 등을 확인했다.
알테오젠도 아일리아 시밀러 ALT-9에 대한 임상3상이 진행중에 있다. 또 아미코젠 자회사 로피바이오도 한국식품의약품안전청(KFDA)에 황반변성치료제 아일리아 바이오시밀러 임상 3상 시험 시험 승인을 신청하면서 시밀러 경쟁에 합류했다.
글로벌 빅파마인 로슈와 바이엘도 아일리아 시장에서 경쟁을 벌인다. 바이엘은 아일리아를 고농도 제형으로 추가 개발한 아일리아HD를 미국 식품의약국(FDA)으로부터 허가 승인을 받았으며, 로슈는 바비스모(성분명: 파리시맙)으로 아일리아와 일전을 벌일 계획이다.
리제네론이 개발한 아일리아는 지난해 글로벌 매출 97억5699만달러(약 12조6841억원)를 달성한 안과 질환 치료제다. 아일리아의 미국 독점권은 내년 5월, 유럽 물질특허는 2025년 11월에 만료될 예정이다.
한편 리제네론은 최근 삼성바이오에피스를 상대로 '아일리아' 특허와 관련해 미국 사법부(웨스트버지니아 지방 법원)에 소송을 제기한 바 있다.

