전이성 유방암표적치료제로 임상결과 우수
기존 치료제 안 듣던 환자에게 성공적일 것
[서울와이어 김지윤 기자] 전이성 유방암 환자가 마지막으로 희망을 걸던 ‘엔허투(트라스투주맙데룩스테칸)’가 국내 허가를 취득했다.
식품의약품안전처(식약처)는 지난 19일 한국다이이찌산쿄와 아스트라제네카의 신약 엔허투가 허가받았다고 밝혔다.
엔허투는 다이이찌산쿄와 아스트라제네카가 공동 개발한 사람상피세포증식인자수용체2형(HER2) 표적 항제-약물 접합체(ADC)다. 국제 학회에서 주목됨과 동시에 전이성 유방암과 위암 환자 임상에서 기존 치료제 대비 효과가 우수했다.
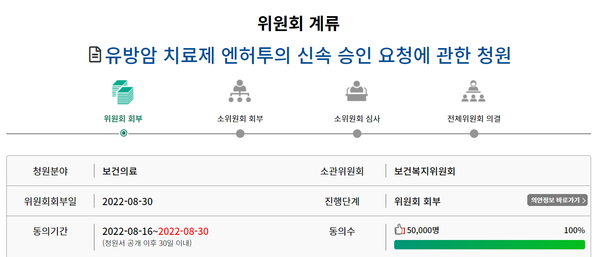
앞서 이러한 효과 결과에 더불어 엔허투는 허가를 놓고 지난 8월16일 국민청원에 올라 7일 만에 2만명이 돌파하며 끝내 5만명의 동의를 얻었다. 이는 사람의 관심에서 비교적 벗어난 제약분야에서는 드문 일로 화제가 된 바 있다.
실제 유방암을 앓는 성인 환자 184명 대상의 임상 2상 ‘DESTINY-Breast 01’에 따르면 엔허투는 연구에 참여한 2개 이상 항 HER2 요법을 투여한 절제 불가능 및 전이성 HER2 양성 유방암 환자에 60.7%라는 확정 객관적 반응률(confirmed ORR)을 나타냈다.
무진행생존기간 중앙값(mPFS)과 반응기간 중앙값(mDOR)은 각각 16.4개월, 14.8개월로 발표됐다.
위암 환자 대상 임상 2상 'DESTINY-Gastric 01'에서 연구에 참여해 최소 2개 이상 치료를 받은 국소 진행성 및 전이성 HER2 양성 위 또는 위식도접합부 선암종 환자에 48.4%란 객관적 반응률을 기록해 기존 화학요법 수치인 12.9% 대비 훨씬 우수했다.
엔허투와 화학요법 치료군의 전체생존기간 중앙값(mOS)은 각각 12.5개월과 8.3개월, 무진행생존기간 중앙값(mPFS)은 각각 5.6개월과 3.5개월로 엔허투가 효과 기간이 확실하고 길었다.
엔허투가 아직까지 사람들의 이목을 받는 것은 임삼 3상 연구 중 전이성 유방암 환자를 대상으로 한 ‘DESTINY-Breast 04’가 미국임상종약학회 연례학술대회(ASCO 2022)로부터 그 효과가 발표된 덕분이다.
ASCO에 따르면 엔허투는 기존 화학요법에 비해 환자 무진행생존기간 중앙값(mPFS), 전체생존기간 중앙값(mOS)을 2배정도 연장시켰다.
허가받은 효능 및 효과는 ▲이전 두 개 이상 항 HER2 기반의 요법을 투여받은 절제 불가능 및 전이성 HER2 양성 유방암 환자 치료 ▲이전 항 HER2 치료 포함 두 개 이상 요법을 투여받은 국소 진행성 및 전이성 HER2 양성 위나 위식도접합부 선암종 치료부문이다.
식약처는 19일 엔허투 허가 소식을 밝히며 “기존 치료제로 치료가 어렵던 HER2 발현 유방암 및 위암 환자에게 새로운 치료 기회를 제공할 것으로 기대한다”고 말했다.
- 셀트리온, 대만서 '트룩시마' 특허 소송 승소
- 질병청 "마스크 완화 검토… 실외마스크 완전 해제가 우선"
- 질병청, "영유아 실내 마스크 완화 우선 검토"
- 코로나 신규확진 4만7917명, 위중증·사망자 감소
- 아이유, '개방성 이관증'으로 공연준비 난관… 어떤 질환이길래?
- 식약처, 미래 이끌 '식약 규제과학 인재' 양성
- 식약처, 내년부터 바뀌는 '유통기한→소비기한' 안내 나서
- 식약처, 주사제 유리 앰플 '안전 사용법' 영상으로 안내
- 식약처, '의약품 허가' 공식소통채널 상담 가능
- 일동제약, 먹는 코로나19 치료제 '조코바' 국내 상용화 되나?
- 식약처, 혁신 의료제품 개발 지원 'GIFT 프로그램' 본격화
- 식약처, "약 온라인 판매·구매는 불법"
- 8월 식약처 의약품 특허등록 31건… 절반이 아스트라제네카
- 식약처, 화이자 코로나 2가백신 허가심사 착수
- 코로나 이후 세번째 수능…제약업계 "영양제로 컨디션 회복"
- 지참금 적다며 아내 신장 적출한 인도 남편… "팔아서 시누이와 나눠가져"
- 동아제약, 보습·항균되는 '솔리아 핸드미스트' 선봬
- 한국콜마홀딩스 "무궁화 꽃의 정신 알리겠다"
- 휴온스푸디언스, '이너셋데이 이벤트' 진행
- 페북의 시대 막 내리나… 메타의 날개없는 추락
- 혼란스러운 '만 14세 미만' 마스크 착용… "의무? 예외?" 정답은?
- 비아그라 먹고 11살 성폭행 한 80대 남성 '징역 20년' 구형
- 염색샴푸 열풍에, 강력한 후발 '제약사' 나섰다
- 반려견 요요하듯 다루는 아이 말리자, 부모 "동물학대 아니다"
- 블랙핑크, K팝 걸그룹 첫 '빌보드 차트 1위'...10월 15일 월드투어 대장정
- 오미크론, '면역회피력' 높은 역대급 새 변이 나왔다
- 옛날이나 지금이나… 제약사 광고에 '빠져드는' 이유

